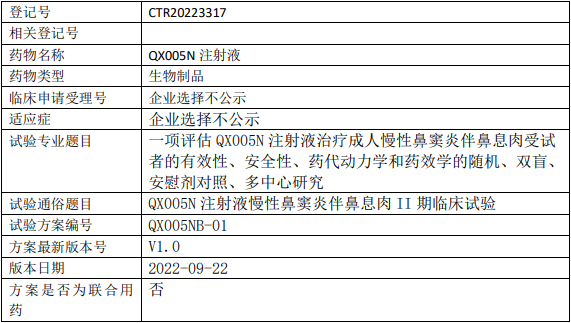
荃信生物QX005N临床试验,QX005N注射液治疗慢性鼻窦炎伴鼻息肉的II期临床试验
试验目的
主要目的
评价QX005N注射液多次皮下注射给药在成人慢性鼻窦炎伴鼻息肉(CRSwNP)患者中的有效性。
次要目的
评价QX005N注射液多次皮下注射给药在成人CRSwNP患者中的安全性、耐受性、药代动力学(PK)特征和免疫原性。
探索性目的
探索QX005N注射液多次皮下注射给药在成人CRSwNP患者中的药效学(PD)特征。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者充分了解试验目的、性质、方法以及可能发生的不良反应,自愿作为受试者,并签署知情同意书(ICF),能够遵守ICF并按照方案要求完成研究;
2、签署知情同意书时,受试者年龄为18-70岁(含界值),男性或女性;
3、确诊为慢性鼻窦炎伴双侧鼻息肉,诊断标准符合《中国慢性鼻窦炎诊断和治疗指南(2018)》;
4、筛选时双侧内镜鼻息肉评分(NPS)≥5分(总分为8分),且单侧NPS均≥2分;
5、筛选时至少存在以下两种症状:鼻塞、黏性或黏脓性鼻涕、头面部胀痛、嗅觉减退或丧失(其中主要症状中的鼻塞、黏性或黏脓性鼻涕必具其一);
6、筛选时接受过下述治疗或存在下述情况,但仍存在双侧CRSwNP,包括:
-筛选前2年内接受过系统性糖皮质激素(SCS)治疗;
-和/或有SCS治疗的禁忌症,或不耐受SCS治疗;
-和/或筛选前6个月之前接受过鼻息肉手术治疗;
7、筛选前需要规律的使用较稳定剂量的鼻用糖皮质激素(INCS)≥4周;
8、随机前至少持续28天接受糠酸莫米松鼻喷雾剂(MFNS)给药(200μg/天,且愿意在研究期间保持稳定剂量使用的患者。注:对于在筛选前使用非MFNS的INCS替代产品的患者,研究者必须将患者在V1时改用MFNS;
9、同意在试验期间以及末次给药后6个月内无生育计划且自愿采取有效避孕措施。
排除标准
1、对试验用药品的任何辅料或其他任何兔源或人源蛋白过敏,或对免疫球蛋白产品有过敏反应;
2、先前接受过度普利尤单抗注射液(Dupilumab)或其他IL-4或IL-13靶点药物治疗的患者;
3、SNOT-22评分<7;
4、正在使用或在如下时间内使用过本研究禁止使用的药物;
-筛选前2个月内或在研究期间计划使用系统性糖皮质激素(SCS)治疗;
-在随机前8周或5个半衰期(以较长者为准)内曾使用过生物制剂/系统性免疫抑制剂(包括但不限于甲氨蝶呤、环孢素、麦考酚酸盐、他西洛莫司、青霉胺、磺胺嘧啶、羟基氯喹、硫唑嘌呤、环磷酰胺)治疗炎症性疾病或自身免疫性疾病(例如,类风湿性关节炎、炎性肠病、原发性胆汁性肝硬化、系统性红斑狼疮、多发性硬化等);
-筛选前130天内接受过IgE靶点药物治疗(奥马珠单抗),或仍处于上述药物的5个半衰期内(以较长的时间为准);
-筛选前60天内接受过其他单克隆抗体药物治疗或参加过此类药物的临床试验,或仍处于上述药物的5个半衰期内(以较长的时间为准);
-筛选时使用白三烯拮抗剂/调节剂治疗,但未连续稳定治疗≥30天的患者(在筛选前已接受稳定剂量持续治疗≥30天者可以入组);
-筛选前3个月内或计划在研究期间进行过敏原免疫治疗;
5、筛选前6个月内接受过任何鼻部手术的患者;
6、合并患有影响本研究疗效评估的疾病或症状的患者,例如:
-上颌窦后鼻孔息肉;-鼻中隔偏曲导致至少一个鼻孔阻塞;
-筛选时或筛选前2周内发生急性鼻窦炎、鼻部感染或上呼吸道感染;
-持续性药物性鼻炎;
-已知或疑似诊断为囊性纤维化;
-慢性肉芽肿性疾病和肉芽肿性血管炎、肉芽肿性多血管炎(韦格纳肉芽肿)、嗜酸性肉芽肿性多血管炎(Churg-Strauss综合征)、杨氏综合征、原发性纤毛运动障碍综合征(卡塔格内综合征)或其他纤毛运动障碍综合征;
7、CT扫描或有症状提示患有变应性真菌型鼻窦炎;
8、合并哮喘的患者如满足以下任一条件将被排除:
-用力呼气量(FEV1)≤预测正常值的60%;
-筛选前3个月内哮喘发生恶化需要系统性(口服和/或肠胃外)类固醇治疗或住院(>24小时)治疗;
-正在使用剂量>1000μg的氟替卡松或与之等效的吸入性皮质类固醇药物;
9、导入期间不愿意进行患者日记每日症状评估及保持稳定剂量的MFNS的患者,或在V2时判断依从性差的患者;
10、对研究中规定使用的标准治疗(MFNS)有禁忌症或其他不耐受情况;
11、妊娠期、备孕期、哺乳期的女性;
12、育龄期女性无法满足下列条件:
-在筛选期和首次接受试验用药品治疗前妊娠试验阴性;
-以及同意在研究期间及末次给药后6个月内:
采取有效的避孕措施;或实施了女性绝育术(如子宫切除、两侧输卵管结扎或双侧卵巢切除);
或在当地政策允许的情况下,按照首选和惯常的生活方式节制性生活(周期性禁欲,例如安全期、排卵期等方法,不属于节制性生活);(绝经女性(定义为无其他原因连续≥12个月闭经)不需要使用额外的避孕措施。)
13、被诊断为活动性寄生虫感染者;寄生虫感染疑似或高风险者(除非随机前通过临床和实验室检查评估排除活动性感染);
14、具有临床意义的肾脏、肝脏、心血管、代谢、神经、血液、眼科、呼吸、胃肠、脑血管、肿瘤、一般情况较差、精神病患者或其他显著医学疾病或障碍病史的受试者,根据研究者的判断,这些疾病或障碍可能会干扰研究或需要进行可能干扰研究的治疗。包括但不限于未控制的糖尿病、未控制的高血压和活动性肝炎;
15、有已知或疑似免疫抑制的疾病病史者,包括侵袭性机会性感染史(例如,结核病、组织胞浆菌病、李斯特菌病、球孢子菌病、肺孢子菌病、曲霉病);
16、有急性或慢性感染的证据,筛选时体温>38℃或在筛选前4周内用抗生素、抗病毒药或抗真菌药积极治疗的慢性、持续或复发性感染,或根据研究者判断的其他频繁、复发性感染;
17、急性哮喘发作及其他肺部疾病患者;
18、患有活动性自身免疫病或使用免疫抑制治疗治疗自身免疫病的患者(如桥本甲状腺炎、格雷夫斯病、炎症肠病、原发性胆汁性肝硬化、系统性红斑狼疮、多发性硬化症、寻常型银屑病、类风湿性关节炎);
19、筛选时有任何一项传染病筛查指标符合以下标准:
-有活动性结核病史,或筛选时有活动性、潜伏性结核菌感染(当T-spot.TB或QuantiFERON-TBGold筛查阳性时,若明显高于正常界限值,直接排除;若略高于参考值上限,需要另一家三甲医院复查确证,若仍高于参考值上限,则排除);
-乙肝五项中HBsAg阳性(HBsAg阴性但HBcAb阳性时,则需要加做HBV-DNA定量检查,HBV-DNA检测结果≥各中心参考值上限或需要抗病毒治疗的患者不符合参与研究的条件);
-丙肝抗体阳性(若丙肝抗体阳性,应进行HCV-RNA确认);
-梅毒抗体阳性(若梅毒螺旋体血清学试验为阳性,则进一步进行非梅毒螺旋体血清学试验,后者为阴性并经研究者判断为过去曾感染梅毒但已治愈的患者符合入选条件);
-HIV感染史,或HIV抗体阳性;
20、筛选前12周内的接种过活疫苗或研究期间计划接种活(减毒)疫苗;
21、受试者交流、理解和合作能力不够,或有不依从医嘱服药史,或存在其他可能干扰受试者依从方案的情况(如:患有精神疾病、经常旅行、缺乏参试动机等);
22、研究者判定患者有其它不适合参加本研究的症状或事项。
